Temel MKT denklemi ve sıcaklık ölçümü
İstatistiksel süreçlerin incelenmesiSistemler, parçacıkların minimum büyüklüğü ve bunların çok sayıda tarafından karmaşıktır. Her bir parçacığı ayrı ayrı düşünmek neredeyse imkansızdır, bu nedenle istatistiksel değerler verilmiştir: parçacıkların ortalama hızı, bunların konsantrasyonu, parçacığın kütlesi. Sistemin durumunu mikroskopik parametreler için izin ile karakterize eden formüle, gazların moleküler-kinetik teorisinin (MKT) temel denklemi denir.
Parçacıkların ortalama hızı hakkında biraz
Parçacıkların hareket hızının belirlenmesi ilkdeneysel olarak gerçekleştirilmiştir. Otto Stern tarafından yürütülen okul program deneyiminden bilinen, parçacıkların hızları hakkında bir fikir yaratmasına izin verdi. Deney sırasında, dönen atomlardaki gümüş atomlarının hareketi incelenmiştir: ilk olarak, tesisatın sabit durumunda, daha sonra belirli bir açısal hızda döndüğünde.
Sonuç olarak, moleküllerin hızının olduğu bulunmuştur.gümüş sesin hızını aşıyor ve 500 m / s. Gerçek şu ki oldukça ilginç, çünkü parçacıkların hareket halindeki hızlarını anlamak zor.
Mükemmel gaz
Araştırmalara devam etmek mümkünSadece parametreleri fiziksel enstrümanlar kullanılarak doğrudan ölçümlerle belirlenebilen bir sistemde. Hız bir hızölçer ile ölçülür, ancak bir hızölçer tek bir parçacığa ekleme fikri saçmadır. Sadece parçacıkların hareketi ile ilişkili sadece makroskopik parametre doğrudan ölçebilirsiniz.

Etkileşen herhangi bir sistemPotansiyel enerji ve hareket kinetik enerjisi ile karakterize edilir. Gerçek gaz karmaşık bir sistemdir. Potansiyel enerjinin değişkenliği sistemleştirilemez. Sorun, etkileşimin karmaşıklığını temizleyen gazın karakteristik özelliklerini taşıyan bir model sunulmasıyla çözülebilir.
İdeal gaz, maddenin içinde bulunduğu bir durumdur.Parçacıkların etkileşimi göz ardı edilebilir, etkileşimin potansiyel enerjisi sıfıra iner. Önemli olan sadece parçacıkların hızına bağlı olan hareket enerjisinin önemli olduğu düşünülebilir.

İdeal gaz basıncı
Gaz basıncı ve hız arasındaki ilişkiyi tanımlamakparçacıklarının hareketi, ideal bir gazın MKT temel denklemine izin verir. Bir gemide hareket eden bir parçacık, bir duvarla çarpıştığında, ona Newton'un ikinci yasası temelinde belirlenebilen bir nabız atışını iletir:
- Ft = 2m0vx
Bir parçacığın momentumundaki bir elastik darbedeki değişim, hızının yatay bileşenindeki bir değişiklikle ilişkilidir. F, kısa bir süre t için duvardaki partikülün tarafına etki eden kuvvettir; m0 Parçacık kütlesidir.
Bir yüzey alanıyla S, bir süre boyunca tüm gaz partikülleri yüzey yönünde v hızıyla çarpışır.x ve bir hacim Sv silindirinde yer alırxAt. Bir parçacık konsantrasyonunda, moleküllerin tam olarak yarısı duvara, ikinci yarısına - karşı yöne doğru hareket eder.
Tüm parçacıkların çarpışmasını düşündükten sonra, Newton yasasını pratiğe etki eden kuvvet için yazabiliriz:
- Ft = nm0vx2SΔt
Gaz basıncı, yüzeye dik olarak hareket eden kuvvetin, ikincisinin alanına oranı olarak tanımlandığından, şunu yazabiliriz:
- p = F: S = nm0vx2
Temel MKT denklemi olarak ortaya çıkan ilişki tüm sistemi tarif edemez, çünkü sadece bir yönde hareket düşünülür.
Maxwell dağılımı
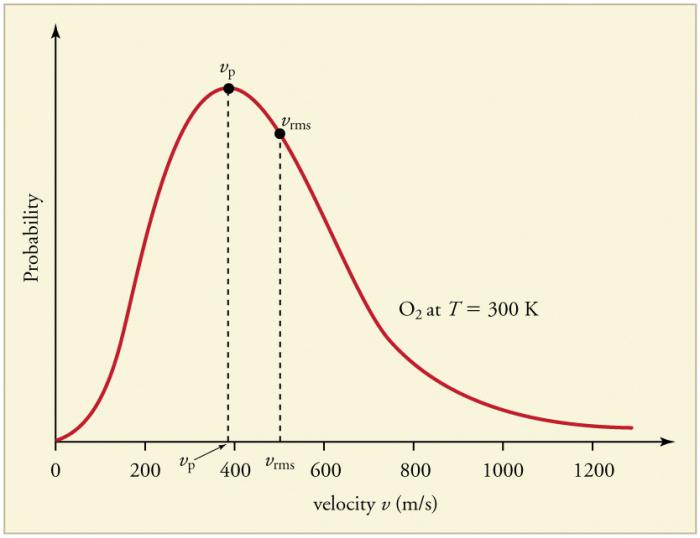
Ile gaz partiküllerinin sürekli sık çarpışmalarDuvarlar ve birbirleriyle, parçacıkların hızları (enerjiler) açısından belirli bir istatistiksel dağılımın kurulmasına yol açar. Tüm hız vektörlerinin yönleri aynı derecede olasıdır. Bu dağıtım Maxwell dağıtımı olarak adlandırıldı. 1860'da, bu örüntü, Maxwell tarafından MKT temelinde çıkarılmıştır. Dağıtım kanununun ana parametreleri hızlardır: olasılık, eğrinin maksimum değerine karşılık gelir ve rms vkare = √ <v2> Parçacık hızının ortalama karesidir.
Gaz sıcaklığındaki bir artış, hızların değerindeki bir artışa karşılık gelir.
Tüm hızların eşit olduğu ve modüllerinin aynı değere sahip olduğu gerçeğinden yola çıkarak şunu söyleyebiliriz:
- <v2> = <Vx2> + <Vy2> + <Vz2>, Gönderen: <vx2> = <V2>: 3
Gaz basıncının ortalama değerini dikkate alan temel MKT denklemi:
- p = nm0<v2>: 3.
Bu ilişki, mikroskopik parametreler arasındaki ilişkiyi belirlemesi bakımından benzersizdir: hız, parçacık kütlesi, parçacık konsantrasyonu ve bir bütün olarak gaz basıncı.
Parçacıkların kinetik enerji kavramını kullanarak, temel MKT denklemi farklı bir şekilde yeniden yazılabilir:
- p = 2nm0<v2>: 6 = 2n <Eiçin>: 3
Gaz basıncı parçacıklarının kinetik enerjisinin ortalama değeri ile orantılıdır.
sıcaklık
Değişmeyen miktarda gaz için ilginçtir.Kapalı bir kap gaz basıncı ve ortalama parçacık enerji enerjisi ile ilişkilendirilebilir. Basıncın ölçülmesi, parçacıkların enerjisinin ölçülmesiyle yapılabilir.
Ne yapmalıyım? Kinetik enerji ile hangi değer karşılaştırılabilir? Böyle bir değer sıcaklıktır.


Evrensel sıcaklık ölçeği
Bağımsızlık açısından daha ilginçÇalışma sıvısının özellikleri gaz termometreleri olarak düşünülebilir. Ölçekleri kullanılan gaz türüne bağlı değildir. Böyle bir cihazda, gaz basıncının sıfıra düştüğü sıcaklığı hipotetik olarak belirleyebiliriz. Hesaplamalar bu değerin -273.15'e karşılık geldiğini gösterir. yaklaşıkS. Sıcaklık skalası (mutlak sıcaklık skalası veya Kelvin skalası) 1848'de tanıtıldı. Bu ölçeğin ana noktası, sıfır gaz basıncının muhtemel sıcaklığı olarak alınmıştır. Birim ölçek segmenti, Santigrat ölçeğinin birim değerine eşittir. Gaz işlemlerini incelerken, sıcaklık kullanarak temel MKT denklemini yazmak daha uygundur.
Basınç ve sıcaklık ilişkisi
Deneysel olarak, gaz basıncının orantılılığını sıcaklığına göre doğrulayabiliriz. Aynı zamanda, basıncın partikül konsantrasyonuna doğru orantılı olduğu bulunmuştur:
- P = nkT,
T mutlak sıcaklıktır, k, 1.38'e eşit bir sabit değerdir • 10-23J / K.
Tüm gazlar için sabit bir değere sahip olan temel değer Boltzmann sabiti olarak adlandırılır.
Basıncın sıcaklığa bağımlılığı ve MKT gazlarının temel denklemleri karşılaştırılarak şöyle yazılabilir:
- <Eiçin> = 3kT: 2
Gaz moleküllerinin kinetik hareket enerjisinin ortalama değeri, sıcaklığına orantılıdır. Yani sıcaklık, parçacık hareketinin kinetik enerjisinin bir ölçüsü olarak hizmet edebilir.