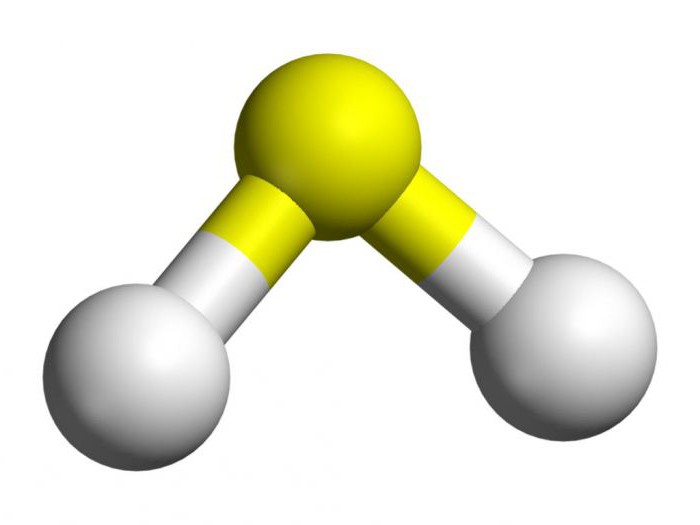
Kükürtün fiziksel ve kimyasal özellikleri
Kükürt - doğada oldukça yaygındırbir kimyasal element (yerkabuğunun içinde on altıncı ve doğal sularda altıncı olan). Hem doğal sülfür (elementin serbest hali) hem de bileşikleri vardır.

Doğada kükürt
Kükürtün en önemli doğal mineralleri arasında,demir piritler, sfalerit, galena, cinnabar, antimonit adı. Okyanuslarda, esas olarak doğal suların sertliğini belirleyen kalsiyum, magnezyum ve sodyum sülfatları şeklinde bulunur.
Kükürt nasıl olur?
Sülfürik cevherlerin ekstraksiyonu, farklı yöntemler ile gerçekleştirilir. Kükürt üretmek için ana yol, doğrudan zemini koklamaktır.
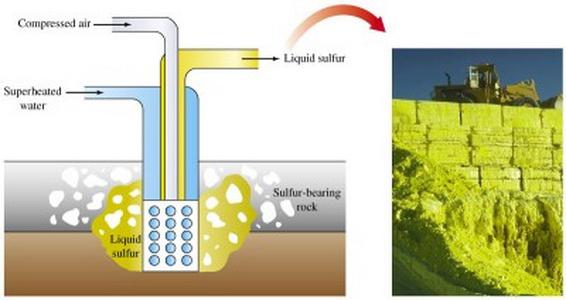
Açık ekstraksiyon yöntemi sağlarSülfürik cevheri kaplayan kaya katmanlarını kaldırarak ekskavatörlerin kullanımı. Cevher katmanlarını ezdikten sonra, patlayıcılar suya gönderilir.
Sanayide sülfür yan ürün olarak alınır.Petrol rafinasyonu sırasında eritme fırınlarında ürün süreçleri. Büyük miktarlarda, kullanılan ekipmanın duvarlarında biriktirildiği, doğal gazda (sülfürlü anhidrit veya hidrojen sülfür formunda) bulunur. Gazdan yakalanan ince dispersiyonlu kükürt, kimya sanayinde çeşitli ürünlerin üretimi için hammadde olarak kullanılmaktadır.
Bu madde doğal olarak elde edilebilirkükürt dioksit gazı. Bunun için Claus yöntemi kullanılır. İçinde kükürt gazlarının bulunduğu "kükürt çukurları" nın uygulanmasından oluşur. Sonuç, asfalt üretiminde yaygın olarak kullanılan modifiye bir sülfürdür.
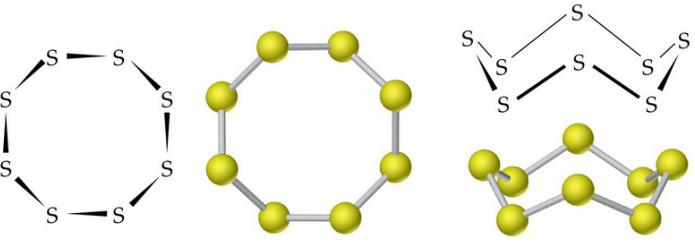
Temel allotropik sülfür modifikasyonları
Sülfür allotropide doğaldır. Çok sayıda allotropik modifikasyon bilinmektedir. En ünlüsü rhombic (kristalin), monoklinik (acicular) ve plastik sülfürdür. İlk iki değişiklik stabildir, üçüncüsü katılaşmada rhombic olana dönüşür.

Sülfürü karakterize eden fiziksel özellikler
Ortorombik (a-S) ve monoklinik (β-S) modifikasyonların molekülleri, kapalı bir döngüde tek kovalent bağlarla bağlanan 8 sülfür atomunu içerir.
Normal şartlar altında, sülfür eşkenar bir modifikasyona sahiptir. Bu g / cc 2.07'lik bir yoğunluğa sahip bir katı, sarı kristalli bir3. 113 ° C'de erir. Monoklinik kükürt yoğunluğu 1,96 g / cm'dir.3erime noktası 119.3 ° C'dir.
Eritme sırasında, sülfür hacmi artar ve160 ° C'lik bir sıcaklıkta kırılan ve yaklaşık 190 ° C'ye ulaştığında koyu kahverengi bir kütleye dönüşen sarı bir sıvı haline gelir. Bu değeri aşan sıcaklıklarda sülfürün viskozitesi azalır. Yaklaşık 300 ° C'de tekrar akışkan bir sıvı haline dönüşür. Bu, kükürtün ısıtılması sırasında zincirin uzunluğunun artan sıcaklıkla arttırılmasıyla açıklanır. Ve sıcaklık değeri 190 ° C'yi aştığında, polimer üniteleri yok edilir.

Kükürt eriyiği doğal olarak soğuduğundasilindirik potalar, sözde gri-elmas tırtıklı kristaller, kısmen kesik kenarları veya açıları olan oktahedra formunda bozuk bir şekle sahip olan oluşur.
Erimiş madde keskin isesoğutma (örneğin, soğuk su yardımıyla), 2.046 g / cm yoğunluğa sahip, kahverengi veya koyu kırmızı bir elastik kauçuksu kütle olan plastik kükürt elde etmek mümkündür.3. Bu modifikasyon, rhombic vemonoklinik, dengesizdir. Yavaş yavaş (birkaç saat içinde) renk sarıya dönüşür, kırılgan hale gelir ve eşkenar dörtgen olur.
Sıvı azot ile kükürtlü buharlar (kuvvetle ısıtılmış) dondurulurken, eksi 80 ° C'nin altındaki sıcaklıklarda stabil olan mor modifikasyonu oluşur.
Sulu ortamda, kükürt pratik olarak çözünmez. Bununla birlikte, organik çözücüler içinde iyi çözünürlük ile karakterizedir. Kötü davranış elektrik ve ısı.
Sülfürün kaynama noktası 444.6 ° C'dir. Kaynama prosesine, ağırlıklı olarak S'den oluşan turuncu-sarı buharların bırakılması eşlik eder.8sonraki ısıtma üzerine ayrışarak S'nin denge formlarının oluşmasıyla sonuçlanır.6S4 ve S2. Dahası, ısıtıldığında, büyük moleküller bozulur ve 900 derecenin üzerindeki sıcaklıklarda, çiftler esasen sadece S moleküllerinden oluşur.2, 1500 ° C'de atomlara ayrışır.
Sülfürün kimyasal özellikleri nelerdir?
Sülfür tipik olmayan bir metaldir. Kimyasal olarak aktiftir. oksidasyon-Sülfürün indirgenme özellikleri ortaya çıkar.öğeler kümesine ilişki. Isıtıldığında, metalik cevherlerde zorunlu varlığını açıklayan pratik olarak tüm elemanlarla kolayca bağlanır. İstisnalar Pt, Au, I2N2 ve inert gazlar. Bileşiklerde kükürt gösteren -2, +4, +6 oksidasyon derecesi.
Kükürt ve oksijenin özellikleri havada yanmasına neden olur. Bu etkileşimin sonucu sülfürün oluşumu (SO)2) ve sülfürik (SO)3sülfürik ve sülfürik asitlerin üretimi için kullanılan anhidritler.
Oda sıcaklığında, kükürt azaltma özellikleri olarak, oluşturulmuş olan kükürt heksafluorür ile reaksiyona sokularak florin ile ilgili olarak ortaya çıkar:
- S + 3F2 = SF6.
Isıtıldığında (bir eriyik halinde) klor, fosfor, silikon, karbon ile etkileşime girer. Hidrojen ile reaksiyonların bir sonucu olarak, hidrojen sülfide ek olarak, H formülü ile kombine edilen sülfatları oluşturur.2SH.
Sülfürün oksitleyici özellikleri gözlenir.metallerle etkileşim. Bazı durumlarda oldukça şiddetli reaksiyonlar gözlemlenebilir. Metallerle etkileşim sonucunda sülfürler (sülfür bileşikleri) ve polisülfürler (çok sülfürlü metaller) oluşur.
Uzun süreli ısıtma ile, okside iken, konsantre asit oksitleyici maddeler ile reaksiyona girer.
Daha sonra, kükürt bileşiklerinin ana özelliklerini ele alıyoruz.
Kükürt dioksit
Kükürt dioksit olarak da adlandırılan kükürt (IV) oksitve sülfür anhidrit, keskin bir boğucu kokuya sahip bir gazdır (renksiz). Oda sıcaklığında basınç altında sıvılaştırılma özelliğine sahiptir. SO2 bir asidik oksittir. Suda iyi çözünürlük ile karakterize edilmiştir. Bu, sadece sulu çözelti içinde bulunan zayıf, kararsız sülfürlü bir asit üretir. Sülfürlü anhidridin alkalilerle etkileşmesi sonucunda sülfitler oluşur.
Differs oldukça yüksek kimyasalfaaliyet. En belirgin olanları kükürt (IV) oksitin indirgen kimyasal özellikleridir. Bu gibi reaksiyonlara kükürt oksidasyonunun derecesinde bir artış eşlik eder.
Sülfür oksidin oksidatif kimyasal özellikleri güçlü indirgeyici ajanların varlığında (örneğin karbon monoksit) ortaya çıkar.
Kükürt trioksit
Sülfür trioksit (sülfür anhidrit) en yüksek oksittirsülfür (VI). Normal koşullar altında, boğucu bir kokusu olan renksiz, uçucu bir sıvıdır. 16.9 derecenin altındaki sıcaklıklarda donma özelliğine sahiptir. Katı kükürt trioksitin farklı kristal modifikasyonlarının bir karışımı oluşturulur. Sülfür oksidin yüksek higroskopik özellikleri nemli havada "duman" a neden olur. Sonuç olarak, sülfürik asit damlacıkları oluşur.
Hidrojen sülfür
Hidrojen sülfür, hidrojen ve sülfürün ikili kimyasal bir bileşiğidir. 'H2S toksik, renksiz bir gazdır, karakteristir.özellikleri tatlandırıcı lezzet ve çürük yumurta kokusu vardır. Eksi 86 ° C arasında bir sıcaklıkta erir ve -60 ° C'de kaynar Termal olarak dengesizdir. 400 ° C'nin üzerindeki sıcaklık değerlerinde, hidrojen sülfür S ve H'ye ayrışır.2. Etanolde iyi çözünürlük ile karakterizedir. Suda çok kötü çözünür. Suda çözünme sonucunda zayıf hidrojen sülfit oluşur. Hidrojen sülfür güçlü bir indirgeyici maddedir.

Yanıcı. Havada yandığında mavi bir alev görebilirsiniz. Yüksek konsantrasyonlarda birçok metal ile reaksiyona girebilir.
Sülfürik asit
Sülfürik asit (H2SO4) farklı konsantrasyon ve saflıkta olabilir. Susuz halde, kokusu olmayan renksiz yağlı bir sıvıdır.
Maddenin sıcaklığıerir, 10 ° C'dir. Kaynama noktası 296 ° C'dir. Suda iyi çözünür. Sülfürik asit çözündüğünde, hidratlar oluşur ve büyük miktarda ısı açığa çıkar. Tüm sulu çözeltilerin kaynama noktası 760 mm Hg. Mad. 100 ° С'yi aşıyor. Kaynama noktası artan asit konsantrasyonu ile artar.

Maddenin asidik özellikleri, bazik oksit ve bazlarla etkileşirken ortaya çıkar. 'H2SO4 bir dibazik asittir, bunun bir sonucu olarak sülfatlar (orta tuzlar) ve hidrojensülfatlar (asit tuzları) oluşturabilir, bunların çoğu suda çözünür.
Sülfürik asidin en belirgin özellikleri oksidasyon-redüksiyon reaksiyonlarında ortaya çıkar. Bunun nedeni H bileşiminde2SO4 sülfür daha yüksek bir oksidasyon durumuna sahiptir (+6). Sülfürik asidin oksitleyici özelliklerinin tezahürüne bir örnek olarak, reaksiyonu bakır ile gösterebiliriz:
- Cu + 2H2SO4 = CuSO4 + 2H2O + SO2.
Sülfür: kullanışlı özellikler
Kükürt için gerekli bir mikroelementyaşayan organizmalar. Amino asitlerin (metiyonin ve sistein), enzimlerin ve vitaminlerin ayrılmaz bir parçasıdır. Bu eleman proteinin tersiyer yapısının oluşumunda rol alır. Proteinlerde bulunan kimyasal olarak bağlı kükürt miktarı ağırlık bazında% 0.8 ila% 2.4 arasındadır. İnsan vücudundaki elementin içeriği 1 kilogram başına yaklaşık 2 gramdır (yani yaklaşık% 0,2 sülfürdür).
Mikroelementlerin kullanışlı özellikleri zorabartma. Kanın protoplazmasını koruyan kükürt, zararlı bakterilere karşı mücadelede vücudun aktif bir asistanıdır. Pıhtılaşma miktarı miktarına bağlıdır, yani eleman yeterli seviyesini korur. Ayrıca, kükürt vücut tarafından üretilen normal safra konsantrasyonlarının korunmasında önemli bir rol oynar.
Genellikle "güzellik mineral" denir, çünküCildin, tırnakların ve saçın sağlığını korumak için basitçe gereklidir. Chere, bir organizmayı çevrenin çeşitli olumsuz etkilerinden koruyabilmenin temel becerisidir. Bu yaşlanma sürecini yavaşlatır. Kükürt, mevcut çevresel durum göz önüne alındığında, toksinlerin vücudunu temizler ve özellikle şu anda doğru olan radyasyona karşı korur.
Vücutta yetersiz miktarda eser element, cürufların yetersiz atılmasına, bağışıklığın ve canlılığın azalmasına yol açabilir.
Sülfür, bakteriyel fotosentezde bir katılımcıdır. Bakteriyoklorofilin bir bileşenidir ve hidrojen sülfür bir hidrojen kaynağıdır.
Sülfür: endüstride özellikleri ve uygulamaları
En çok kullanılan sülfürsülfürik asit üretimi. Ayrıca, bu maddenin özellikleri, kauçuğun vulkanizasyonu için, tarımda ve hatta bir ilaçta (kolloidal sülfür) bile bir mantar ilacı olarak kullanılmasına izin verir. Ayrıca kükürt, kibrit ve piroteknik bileşiklerin üretimi için kullanılır, kükürt asfalt üretimi için kükürt-bitüm bileşimlerinin bir parçasıdır.